Di pertemuan kali ini kita akan menyampaikan materi tentang perhitungan jumlah mol, Molaritas, Molalitas, Normalitas, dan Fraksi Mol Suatu Larutan. Langsung saja simak pembahasannya berikut.
Daftar Isi
Jumlah Mol
Banyaknya zat / senyawa dinyatakan dalam besaran mol. Konsentrasi molaritas, molalitas, normalitas, & fraksi mol memakai satuan kuantitas zat atau senyawa dalam mol.
Mol adalah suatu gram zat yang dibagi dengan massa molekul relatif (Mr). Mol sebuah senyawa dihitung dengan rumus berikut.
n = gr/Mr
Keterangan:
- n = mol suatu zat (mol)
- Mr = massa molekul relatif suatu zat (gr/mol)
- gr = massa suatu zat (gram)
Molaritas Larutan (M)
Molaritas adalah suatu besaran yang menunjukkan jumlah mol zat terlarut pada setiap satuan volume larutan. Molaritas dinyatakan dengan satuan molar ( M ) atau mol/liter.
Rumus molaritas untuk (n) mol senyawa terlarut dalam ( V ) liter larutan adalah sebagai berikut :
M = n / V
Keterangan:
- M = molaritas suatu zat (mol/L)
- V = volume larutan (ml)
Molalitas Larutan (m)
Molalitas adalah besaran yang menunjukkan jumlah mol zat terlarut pada setiap satuan berat pelarut. Molalitas dinyatakan dalam satuan molal (m) atau mol/kg.
Rumus molalitas untuk (n) mol senyawa yang dilarutkan ke (P) kilogram pelarut adalah sebagai berikut :
m = n / P
Keterangan:
- m = molalitas suatu zat (molal)
- n = mol suatu zat (mol)
- p = massa pelarut (gr)
Normalitas Larutan (N)
Normalitas adalah suatu besaran yang menunjukkan jumlah mol ekivalen zat terlarut pada setiap satuan volume larutan. Normalitas dinyatakan dengan satuan normal (N) atau mol ekivalen/liter.
Besarnya normalitas larutan dapat dihitung dengan rumus berikut:
N = ek / V
atau
N = n × a / V
atau
N = M × a
Keterangan:
- N = normalitas (mol ek/L)
- n = mol suatu zat (mol)
- V = volume larutan (liter)
- a = ekivalen suatu zat
mol ek atau mol ekivalen merupakan jumlah mol dikali jumlah ion OH– atau ion H+. Apabila dalam n mol zat terlarut memiliki sebanyak a OH– atau ion H+, besarnya mol ekivalen (ek) dinyatakan dengan rumus berikut:
Ek = n × a
Untuk asam, 1 mol ek setara dengan 1 mol ion H+
Untuk basa, 1 mol ek setara dengan 1 mol ion OH–
Fraksi Mol Larutan
Fraksi mol adalah perbandingan jumlah mol dari sebuah komponen larutan dengan jumlah mol keseluruhan dari komponen larutan.
Dikarenakan fraksi mol adalah sebuah perbandingan mol, maka fraksi mol tidak memiliki satuan.
Apabila suatu larutan terdiri dari komponen A dan B dengan jumlah mol nA dan nB, maka fraksi mol A (xA) & fraksi mol B (xB) dapat dihitung dengan rumus berikut:
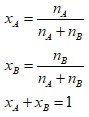
Contoh Soal Molaritas, Molalitas, Perhitungan Mol, Normalitas, dan Fraksi Mol
1. Contoh Soal Perhitungan Mol
Diketahui 10 gr garam dapur (NaCl) mempunyai massa relatif molekulnya 58,5. Maka hitunglah jumlah molnya.
n = gr/Mr
n = 10 gr / (58,5 gr/mol)
n = 0,171 mol
Jadi, 10 gram dari garam dapur memiliki jumlah mol 0,171 mol.
2. Contoh Soal Perhitungan Molaritas Larutan
Diketahui larutan urea (CO( NH2 )2) sebanyak 0,25 liter dibuat untuk melarutkan urea dalam air sebanyak 3 gram yang memiliki massa molekul relatif 60. Maka Molaritas larutan urea adalah:
M = n / V
n = gr/Mr
n = 3 / 60 mol
n = 0,05 mol
M = 0,05 / 0,25 molar
M = 0,2 molar
Jadi, larutan urea memiliki molaritas sebesar 0,2 molar.
3. Contoh Soal Molalitas Larutan
Diketahui natrium hidroksida (NaOH) sebnayak 10 gram dengan massa molekul relatif 40 dilarutkan ke dalam air sebanyak 2 kg. Tentukan molalitas larutan NaOH.
m = n / P
n = 10 / 40 mol
n = 0,25 mol
m = 0,25 / 2 molal
m = 0,125 molal
Jadi, larutan NaOH tersebut memiliki molalitas sebesar 0,125 molal.
4. Contoh Soal Normalitas Larutan
Diketahui larutan NaOH sebanyak 0,5 liter dihasilkan dengan cara melarutkan NaOH (Mr = 40) sebanyak 5 gram ke dalam air. Hitunglah normalitas larutan tersebut
N = ek / V
ek = n × a
n = gr / Mr
n = 5 / 40 mol
n = 0,125 mol
Jumlah ion OH– = a = 1.
ek = 0,125 × 1
ek = 0,125
N = 0,125 / 0,5 N
N = 0,25 N
Jadi, larutan tersebut memiliki normalitas sebesar 0,25 N.
5. Contoh Soal Perhitungan Fraksi Mol
Sebuah larutan tersusun atas garam dapur (Mr = 58,5 sebanyak) 5,85 gram yang dilarutkan ke dalam air (Mr = 18) sebanyak 90 gram. Tentukan fraksi mol garam dapur & fraksi mol air tersebut.
ngaram = 5,85 / 58,5 = 0,1 mol
nair = 90 / 18 = 5 mol
xgaram = ngaram / (ngaram + nair)
xgaram = 0,1 / (0,1 + 5)
xgaram = 0,0196
Xair = nair / (ngaram + nair)
xair = 5 / (0,1 + 5)
xair = 0,9804
xgaram juga dapat dihitung dengan rumus
xair = 1 – xgaram
xair = 1 – 0,0196
xair = 0,9804
Jadi fraksi mol garam dapur adalah 0,0196 & fraksi mol air adalah 0,9804.
Demikian penjelasan lengkap tentang rumus perhitungan mol, Molaritas, Molalitas, Normalitas, dan Fraksi Mol Larutan. Semoga bermanfaat…